Existen más grupos sanguíneos de lo que creemos
María José Candela García, Profesora Colaboradora Honoraria, Universidad de Murcia

“Esto lo sabe responder hasta un niño”, podríamos pensar. “Está la famosa clasificación ABO, y luego el Rh, que puede ser positivo o negativo… y hasta ahí”. Pero lo cierto es que el asunto es bastante más complicado de lo que parece a simple vista.
Los grupos sanguíneos se comportan como antígenos
Empecemos por aclarar el concepto. Los grupos sanguíneos se encuentran en las proteínas e hidratos de carbono que forman parte de la membrana de los hematíes, las células sanguíneas encargadas de transportar el oxígeno.
Los diferentes grupos sanguíneos surgen como consecuencia de mutaciones en el ADN de los genes que los codifican, lo que implica que se trata de características heredadas. La mutación identificada con más frecuencia es el cambio de un solo nucleótido de ADN, lo que en la jerga científica se conoce con las siglas SNPs. La mayoría de los grupos sanguíneos surgen por uno o varios SNPs, que o bien provocan la sustitución de un aminoácido de la proteína o bien dan lugar a una proteína incompleta.
En otros casos lo que se producen son pérdidas (deleciones) de genes completos. El ejemplo más importante son los individuos Rh negativos que carecen del antígeno D por una deleción del gen que lo codifica.
Lo interesante de los grupos sanguíneos es que se comportan como antígenos, lo mismo que las proteínas de los virus y las bacterias que nos infectan. Eso implica que tienen la capacidad de desencadenar una respuesta inmune y la producción de anticuerpos cuando son introducidos en un individuo que carece de ellos, ya sea por una transfusión sanguínea o por un embarazo. Eso provoca, respectivamente, reacciones hemolíticas postransfusionales y enfermedad hemolítica del feto y recién nacido. En el laboratorio detectamos esta unión de antígeno-anticuerpo mediante reacciones de aglutinación.
Descubrimiento del sistema ABO

Los primeros grupos sanguíneos fueron descubiertos en el año 1901 por Karl Landsteiner, que describió las reacciones de aglutinación que se producían al unir hematíes con el plasma de diferentes personas. Los dividió en 3 grupos: grupo A, grupo B y grupo C (actualmente grupo O). Landsteiner dedujo que los hematíes tenían en su membrana unos antígenos que reaccionaban con anticuerpos que presentaban los individuos que carecían de los mismos.
La trascendencia clínica del sistema ABO radica en que todos los individuos presentamos en nuestro plasma anticuerpos contra los antígenos de los que carecemos. Por ese motivo, si se transfunden hematíes ABO incompatibles se produce una reacción hemolítica que puede llegar a ser muy grave e incluso acabar con la vida del paciente.
Eso los diferencia del resto de los anticuerpos eritrocitarios clínicamente significativos, que son de origen inmune y no se producen hasta que no existe un contacto con el antígeno, ya sea por transfusión o durante un embarazo.
Más de trescientos grupo sanguíneos
Después del descubrimiento del sistema ABO, se fueron identificando otros grupos sanguíneos como consecuencia de diferentes eventos patológicos producidos por anticuerpos eritrocitarios, tanto por la enfermedad hemolítica del feto y recién nacido (anti-D, anti-K y anti-Jka) como por reacciones hemolíticas transfusionales (anti-c, anti-e, y anti-Fya). En la tabla siguiente se muestra un resumen de los sistemas antigénicos con más trascendencia clínica.
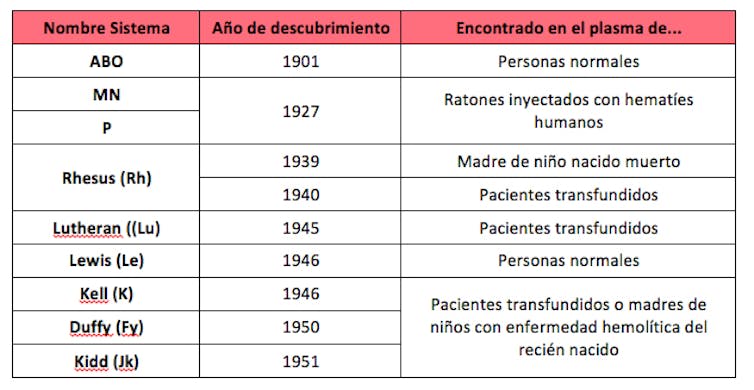
Hasta los años 50 los grupos sanguíneos fueron definidos únicamente mediante reacciones de aglutinación. Entre 1950 y 1970, se empezó a describir la estructura y biosíntesis de los carbohidratos y proteínas de los diferentes antígenos eritrocitarios. Y más tarde, a partir de los noventa, se identificaron los genes que codifican los sistemas ABO, Rh y, posteriormente, el resto de grupos sanguíneos. Que no son pocos.
Según el último informe de la “International Society of Blood Transfusion” del año 2018, se han descrito más de 350 antígenos eritrocitarios. La mayoría de ellos han sido agrupados en 36 sistemas, por compartir características y por tener una herencia estrechamente relacionada.
Sistema Rh “Rhesus”
El sistema más importante después del ABO es el Rh. Aunque existen más de 50 antígenos dentro de este sistema, destaca por encima de todos el antígeno RhD, que es el que diferencia a los individuos Rh positivos de los Rh negativos que carecen de este antígeno. Su importancia se explica en dos brochazos: tiene una enorme capacidad inmunogénica, y está implicado tanto en la enfermedad hemolítica del feto y recién nacido como en las reacciones hemolíticas postransfusionales.
De su identificación no hace ni un siglo. Todo empezó en 1939, cuando Levine y Stetson, investigaron la reacción hemolítica en una mujer transfundida con hematíes del marido después de dar a luz a un hijo muerto. Detectaron en el plasma de la mujer un anticuerpo que producía aglutinación de los hematíes de su marido y del 80% de los hematíes ABO compatibles, llegaron a la conclusión de que este anticuerpo era independiente de los previamente descritos y sugirieron que la mujer se había sensibilizado durante el embarazo por un antígeno, presente en los hematíes del niño, heredado del padre.
Un año después, Landsteiner y Wiener descubrieron un anticuerpo de características similares, obtenido tras inyectar hematíes de macaco Rhesus en conejos. Pensaron que se trataba del mismo anticuerpo y por eso lo denominaron Rh. Posteriormente se vio que se trataba de anticuerpos diferentes pero se mantuvo esta denominación.

Más allá de AB0 y Rh
En el año 1946, el doctor Coombs describió un nuevo anticuerpo en una mujer que había dado a luz a un recién nacido con enfermedad hemolítica. Este nuevo anticuerpo reaccionaba con los hematíes del marido y de dos de sus hijos, además de reaccionar con el 7% de los hematíes de los donantes. Se denominó anti-Kell, por aquella primera paciente en la cual se describió, la señora Kelleher.
Posteriormente se fueron describiendo nuevos anticuerpos a los que también se bautizó con el nombre del paciente en el que se detectaban: anti-Fya (sistema Duffy) y anti-Jka (sistema Kidd), ambos con transcendencia clínica. Otros sistemas se denominaron como el sitio dónde se detectaron, entre ellos el grupo Bombay, detectado por primera vez en esa ciudad.

¿Qué son las pruebas de compatibilidad sanguínea?
Antes de realizar una transfusión sanguínea, es imprescindible hacer todo lo posible para evitar que el paciente presente una reacción hemolítica postransfusional. Ese es el objetivo de las pruebas de compatibilidad.
Dada la trascendencia clínica del sistema ABO y del antígeno RhD, es obligatoria su determinación en las pruebas de compatibilidad y en el seguimiento de la mujer embarazada. Pero además de buscar hematíes grupo ABO y RhD compatibles, es imprescindible descartar la presencia anticuerpos dirigidos contra otros sistemas de grupos eritrocitarios. Para ello se realiza una prueba conocida como COOMBS indirecto, que permite la detección de anticuerpos diferentes del anti-A y/o anti-B, en el plasma de los pacientes.
En caso de que encontremos un COOMBS indirecto positivo, se debe detectar la especificidad del anticuerpo, y buscar hematíes carentes de ese antígeno. Si se trata de una mujer embarazada, es importante realizar un seguimiento para descartar que se produzca enfermedad hemolítica en el feto.
Los grupos sanguíneos “raros”
Existen ciertos individuos cuyos hematíes carecen de un antígeno presente en casi toda la población (lo que se conoce como antígeno de alta incidencia). Eso implica que, en caso de que desarrollen un anticuerpo, por contacto con una sangre extraña, resultará tremendamente difícil encontrar un donante de sangre compatible.
Es el caso de los individuos del llamado grupo Bombay, extremadamente raros, que carecen de los antígenos del sistema ABO, incluyendo el que tienen los individuos de grupo O. Producen un anticuerpo de forma natural que hace que todos los hematíes sean incompatibles excepto los que son como ellos.
Peculiar también es lo que sucede con el sistema Duffy. Este sistema se encuentra en el receptor del Plasmodium vivax, uno de los parásitos causantes de malaria. Eso implica que carecer de él nos proporciona una importante ventaja de supervivencia si vivimos en áreas donde esta enfermedad es endémica. Esta ventaja evolutiva ha dado lugar a que más del 60% de los individuos de raza negra carezcan de este receptor. El problema para estos individuos surge cuando tienen que ser transfundidos en nuestro entorno, y desarrollan anticuerpos contra estos antígenos, presentes en la práctica totalidad de la población caucásica.
En estos pacientes concretos se recomienda recurrir a las autotransfusiones, manteniendo hematíes congelados. También existe un panel nacional e internacional de donantes con grupos raros a los que se les avisa para donar en caso de que haya necesidad.


