Los tres tests del coronavirus que (juntos) nos ayudarán a controlar la pandemia
Ignacio López-Goñi, Catedrático de Microbiología, Universidad de Navarra
Durante una infección el virus se multiplica activamente. Cuando comienza se puede encontrar en muestras biológicas (frotis faríngeo o nasofaríngeo, aspirado traqueal o lavado broncoalveolar). Primero hay un período de latencia en el que todavía no es posible detectar la respuesta del sistema inmune. Después de unos días, comienza a producir anticuerpos. Se producen primero anticuerpos del tipo IgM hasta alcanzar un máximo a los 7-10 días para, más tarde, casi desaparecer. Esta respuesta primaria es indicativa de una infección aguda. Posteriormente se producirá la respuesta inmune secundaria, más rápida, intensa y prolongada. Se producirán anticuerpos de tipo IgG, que durarán más tiempo en la sangre.
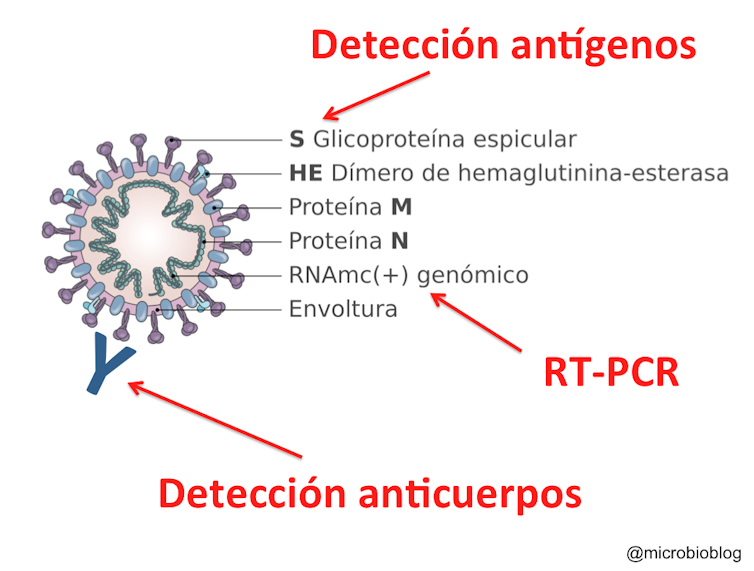
Para detectar la presencia del virus (detección directa) podemos emplear dos tipos de test: la PCR, que detecta el genoma del virus, y los test inmunológicos, que detectan las proteínas (antígenos) del virus. El tercer tipo es el que detecta los anticuerpos producidos como respuesta a la infección: son los test serológicos de detección indirecta.
Aunque hay varias modalidades de cada uno de ellos, vamos a explicar brevemente cómo funcionan.
Detectar el genoma del virus: la RT-PCR
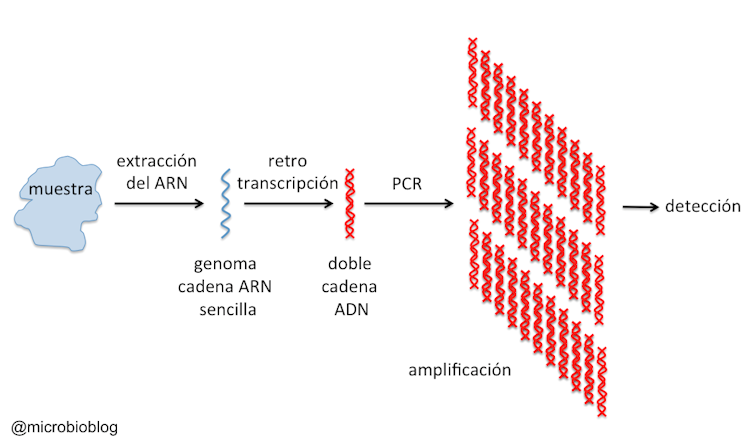
El genoma del coronavirus SARS-CoV-2 es una molécula de ARN monocadena de unos 30 kilobases. Una vez tomada la muestra, lo primero que hay que hacer es extraer el genoma del virus. Esto se hace mediante un kit de extracción de ácidos nucleicos. Así, además de inactivar el virus, obtenemos su genoma ARN.
A continuación, hay que copiar ese ARN en forma de ADN. Eso se hace con otro kit que emplea una enzima que se denomina transcriptasa inversa o retro-transcriptasa (de ahí el “RT” del nombre).
Luego, el genoma del virus en forma de ADN se amplifica mediante la reacción en cadena de la polimerasa (PCR, en inglés. Esta amplificación consiste en hacer millones de copias de un fragmento del ADN de forma que podamos visualizarlo. El sistema de PCR a tiempo real permite incluso cuantificar la muestra. Es decir, saber cuántas copias del virus tenemos por mililitro.
Si la reacción es positiva, demuestra que había ARN del virus y que la persona estaba infectada.
Como lo primero que obtuvimos del virus fue su genoma, este tipo de pruebas son las primeras que se desarrollaron. El 13 de enero la OMS ya publicó el primer protocolo. Normalmente se suelen realizar dos ensayos: uno de cribado y un segundo confirmatorio. Incluso se puede hacer un tercero de confirmación. Estos tres ensayos de RT-PCR se diseñan para detectar tres genes distintos del virus.
Estos test de PCR son muy específicos y sensibles. Suelen tardar en realizarse unas cuantas horas. Requieren un equipamiento y un personal técnico especializado. Pueden dar resultado positivo en personas antes de que manifiesten síntomas, pero que ya tengan el virus. A lo largo de la enfermedad pueden permitir hacer un seguimiento de cómo va la infección, porque cuando la persona ya se ha curado y no tiene el virus activo, en principio debería dar negativo. Aun así, no se puede descartar que pacientes convalecientes sin síntomas puedan dar positivo y seguir siendo portadores del virus.
Detectar las proteínas del virus: test antigénicos
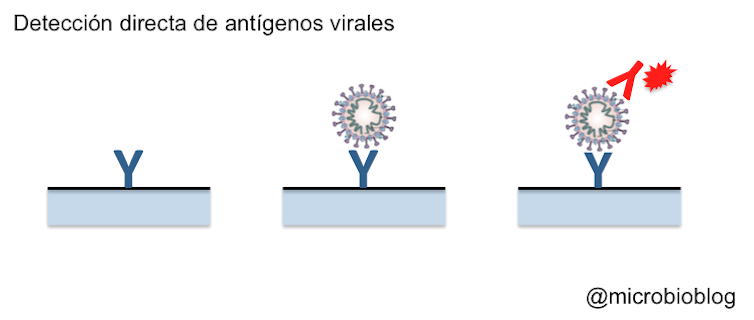
Otra forma de confirmar la presencia del virus es detectar sus proteínas (antígenos). Para ello, sobre un soporte se fijan anticuerpos específicos que reaccionarán contra alguna proteína del virus. En este caso es contra las proteínas de la superficie de la envoltura (proteína S), las que se proyectan hacia el exterior y forman esas espículas que dan el nombre a este tipo de virus, corona-virus.
Si en la muestra hay partículas virales, estas quedarán fijadas al anticuerpo. Es como si el virus hubiera sido capturado por el anticuerpo. A continuación, se añade un segundo anticuerpo contra el virus de manera que se forme un emparedado: anticuerpo-virus-anticuerpo. Este segundo anticuerpo estará marcado o señalado de alguna manera para poner de manifiesto la reacción.
Si la reacción es positiva, demuestra que había proteínas del virus y que la persona estaba infectada.
Este tipo de test basado en la detección de moléculas es muy habitual en diagnóstico clínico. Su fundamento es el mismo que las tradicionales pruebas de detección de drogas y los tests de embarazo.
En el caso que nos ocupa tardó en aparecer en escena porque se requiere el empleo de anticuerpos de captura específicos frente a este virus concreto. La ventaja es que son mucho más rápidos y, según el tipo de soporte, se pueden realizar en unos pocos minutos. No necesitan un equipamiento específico ni un personal técnico altamente cualificado y son más baratos. La desventaja es que son mucho menos específicos y sensibles que la RT-PCR.
Un comentario adicional a ambos test de detección directa del genoma o de las proteínas del virus: que la reacción sea positiva no implica que el virus esté activo y sea infectivo. Podemos detectar su genoma o sus proteínas pero que el virus no esté completo sino que sean sus restos.
Detectar anticuerpos frente al virus: tests serológicos
La tercera aproximación consiste en detectar la respuesta inmune frente al virus: los anticuerpos. Es una detección indirecta en la que no detectamos el microorganismo sino que ponemos de manifiesto la respuesta inmune frente a él. En este caso la muestra que vamos a emplear es una gota de sangre, porque vamos a detectar los anticuerpos generados.
Sobre el soporte se fijan proteínas del virus, normalmente las proteínas más expuestas hacia el exterior, como la proteína S de la envoltura. Esto es así porque nuestro sistema inmune lo primero que reconoce es lo que está más hacia el exterior del virus. Como con este test queremos detectar los anticuerpos que producimos, la muestra será una simple gota de sangre. Si en la muestra hay anticuerpos contra el virus, se pegarán y quedarán fijados a las proteínas del virus.
A continuación, se añade un segundo anticuerpo contra el anticuerpo humano: estos suelen ser anticuerpos de otro animal que reaccionan contra nuestros propios anticuerpos, porque los anticuerpos humanos en realidad actúan como antígenos en otros animales. Se forma así un trío: proteínas del virus-anticuerpo humano-anticuerpo de otro animal. Este segundo anticuerpo estará marcado o señalado de alguna manera para poner de manifiesto la reacción.
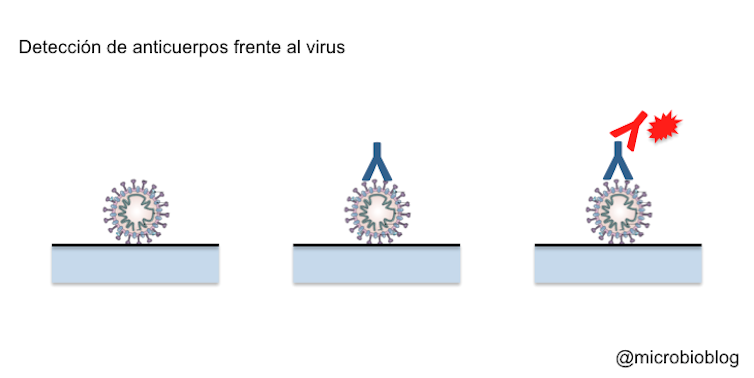
Si la reacción es positiva, demuestra que había anticuerpos contra el virus y que la persona, en algún momento, ha estado en contacto con el virus y su sistema inmune ha reaccionado produciendo anticuerpos. Esto no implica necesariamente que esté infectado, quizá se haya curado, o simplemente ha estado en contacto con el virus y no ha tenido síntomas.
Este tipo de test también se ha desarrollado después que los de RT-PCR, cuando ya hemos tenido suero de pacientes que han pasado la enfermedad. También son mucho más rápidos que la PCR y, según el tipo de soporte, se pueden realizar en pocos minutos. No necesitan un equipamiento especifico ni un personal técnico altamente cualificado y son más baratos. La desventaja es que son mucho menos específicos que la RT-PCR.
Otra importante desventaja de este tipo de test es que nuestro organismo necesita varios días para producir anticuerpos detectables. O sea, que una persona puede estar infectada pero durante los primeros días no dar positivo en este tipo de test.
Algunos test de anticuerpos pueden distinguir el tipo de inmunoglobulina: si es IgM, indicativo de una infección reciente, o IgG, indicativo de una respuesta secundaria y, por tanto, más prolongada.
Sensibilidad y especificidad
Cuando queremos estudiar lo efectivo que es un test diagnóstico lo que hacemos es comparar su resultado en un grupo control de individuos que sabemos que están sanos o infectados. Esto se hace comparando nuestro test con otro que se considera el patrón de referencia. Con estos resultados se construye la tabla que nos muestra la distribución de sanos y enfermos y el resultado del test.
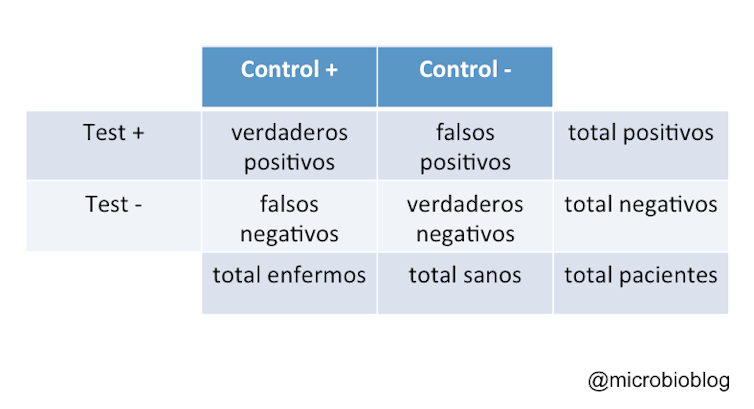
Así, podemos clasificar los pacientes como verdaderos positivos, verdaderos negativos, falsos positivos (no están infectados pero el test es positivo) y falsos negativos (están infectados pero el test es negativo). Con estos datos podremos calcular la sensibilidad y la especificidad de nuestro test.
La sensibilidad del test representa la probabilidad de clasificar correctamente a los infectados o, lo que es lo mismo, la proporción de verdaderos positivos. Es una proporción en la que en el denominador se sitúa el total de infectados y en el numerador los positivos verdaderos:
Sensibilidad = verdaderos positivos / total de infectados
Por su parte, la especificidad de un test representa la probabilidad de clasificar correctamente a los sanos o, lo que es lo mismo, la proporción de verdaderos negativos. Es una proporción en la que en el denominador figuran el total de sanos y en el numerador los negativos verdaderos:
Especificidad = verdaderos negativos / total de sanos
Uno de los problemas de estos parámetros es que la sensibilidad nos dice la probabilidad de clasificar correctamente al enfermo una vez que sabemos que está enfermo. Por su parte, la especificidad nos dice la probabilidad de clasificar correctamente al sano una vez que ya conocemos que está sano. Pero esto en la práctica, muchas veces, lo desconocemos.
Cuando un test diagnóstico tiene tanto la sensibilidad como la especificidad cercanas al 100 % se comporta como un test de referencia y sus resultados serán casi siempre válidos. Sin embargo, esta circunstancia es excepcional, muy pocas veces un test es 100 % sensible y específico. Por eso, se suelen emplear varios test diagnósticos al mismo tiempo, porque nos darán más información de la situación real.
Un pregunta que nos podemos hacer es ¿por qué a veces los test dan resultados falsos? Las causas son múltiples. Los falsos negativos pueden ser debidos a que la liberación del virus sea intermitente, que no se haya extraído correctamente el genoma del virus, que la muestra se haya obtenido durante el periodo ventana en el que todavía no se hayan producido los anticuerpos o fallos en los reactivos del test. Los falsos positivos pueden ser debidos a contaminación en el procesamiento de las muestras o reacción cruzada con otros virus.
¿Qué información nos da la combinación de tests?
El test de RT-PCR nos indica la presencia del virus: quién está infectado en ese momento. Los test de detección de anticuerpos nos indican quién estuvo infectado y quizá está inmunizado, al menos durante un tiempo, contra el coronavirus. Según esto, y con todas las reservas según la sensibilidad y especificidad de cada test, si combinamos resultados de RT-PCR, con detección de anticuerpos (IgM e IgG) se podría plantear lo siguiente:
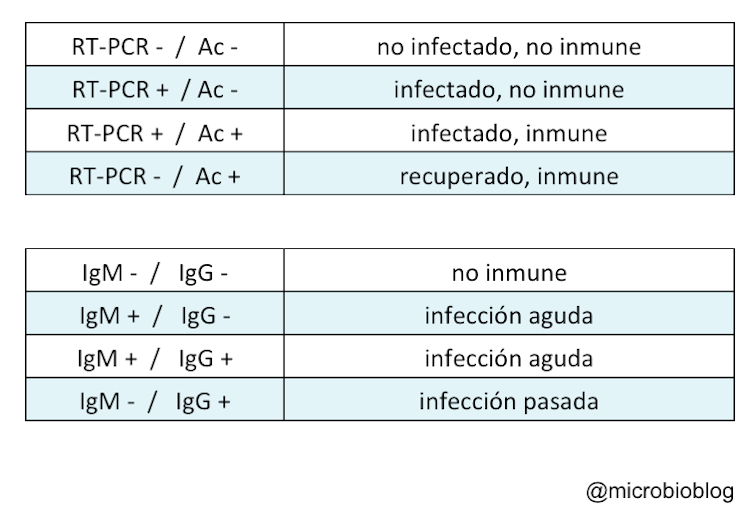
Sin embargo, este planteamiento es una simplificación y tiene sus limitaciones. El que no detectes anticuerpos puede no significar que no estés inmunizado. En el caso de infecciones por virus, que son intracelulares, la inmunidad celular no mediada por anticuerpos es tan importante o más que la mediada por anticuerpos. Es decir, en ocasiones, no hay anticuerpos pero el individuo puede estar inmunizado.
A pesar de ello, todo esto nos puede ayudar a controlar y monitorizar la epidemia en las próximas semanas, conocer cuántas personas han estado en contacto con el virus y están inmunizadas, a definir con mayor exactitud las tasas de letalidad del virus, predecir que podrá ocurrir si hay una segunda oleada y a decidir las medidas y la velocidad del desconfinamiento que todos estamos deseando.
Una versión de este artículo fue publicada originalmente en el blog del autor, MicroBIO.
Ignacio López-Goñi, Catedrático de Microbiología, Universidad de Navarra

